土壤胶体是土壤中高度分散的部分,是土壤中最活跃的物质,其重要性犹如生物中的细胞,土壤的许多理、化现象,例如土粒的分散与凝聚、离子吸附与交换、酸碱性、缓冲性、粘结性、可塑性等都与胶体的性质有关。所以,只有深入研究土壤胶体的性质,才能了解土壤理、化现象发生的本质。
(一)土壤胶体的种类和构造
在胶体化学中,一般指分散相物质的粒径在1—100毫微米之间的为胶体物质,而土壤胶体微粒直径的上限一般取2000毫微米。
1.胶体的种类 土壤胶体按其成分和特性,主要有三种:
1)土壤矿质胶体:包括次生铝硅酸盐(伊利石、蒙脱石、高岭石等)、简单的铁、铝氧化物、二氧化硅等。
2)有机胶体:包括腐殖质、有机酸、蛋白质及其衍生物等大分子有机化合物。
3)有机-无机复合胶体:土壤有机胶体与矿质胶体通过各种键(桥)力相互结合成有机-无机复合胶体。在土壤中有机胶体和无机胶体很少单独存在,只要存在这两类胶体,它们的存在状态总是有机-无机复合胶体。
2.土壤胶体的构造 胶体的构造有两种形式。若胶体内部组成的分子或离子排列组合有严格规律的为晶形胶粒;若排列无严格规律的则属非晶形胶粒。土壤无机胶体多属晶形胶体,有机胶体多属非晶质胶体。
土壤胶体微粒构造(图1-23),从内向外可分为几个圈层:
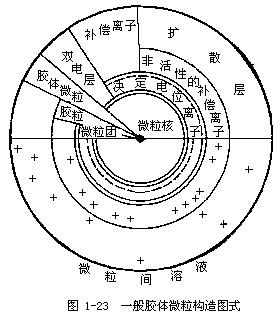
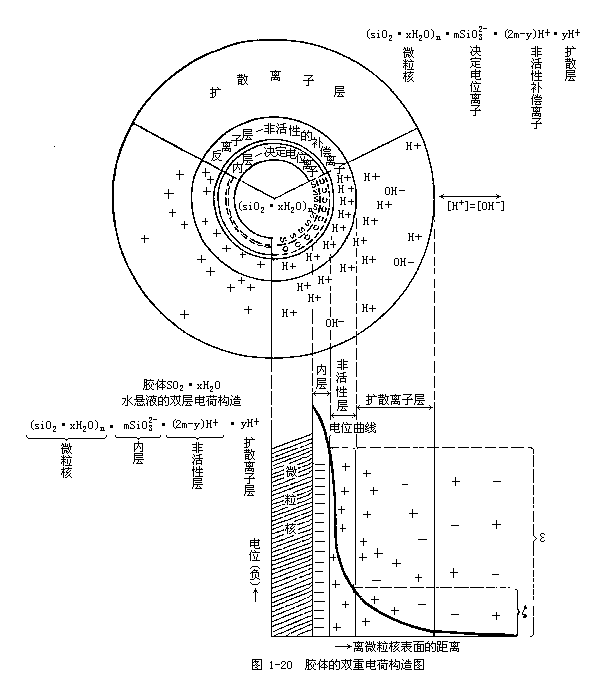
胶核是胶粒的核心,土壤胶体胶核的成分由二氧化硅、氧化铁、氧化铝、次生铝硅酸盐腐殖质等的分子团所组成的微粒核。微粒核表面的分子向溶液介质解离而带有电荷,形成一个内离子层;在内离子层外面,由于电性吸引,形成带有相反电荷的外离子层。这两个电性相反组成的电层,称为双电层。在双电层中,由于内离子层决定着胶体的电位,故又称决定电位离子层;双电层的外层,由于其电荷符号与内层相反,故又称反离子层,亦称补偿离子层。补偿离子层的离子,因距离内层远近不同,所受的电性引力的大小也不同。距离近者受吸引力大,不能自由活动,这一部分的离子层,称为非活性补偿离子层。距离内层较远的部分,受引力较小,活动性较大,并逐渐向溶液介质中过渡,称为活性补偿离子层或离子扩散层。就整个胶粒而言,外层的正电荷数目和内层负电荷数目是相等的,电性是中和的。由上述可知,胶体的基本构造为微粒核和双电层。微粒核与双电层的内层合称为微粒团;微粒团和非活性补偿离子层合称为胶粒。胶粒与离子扩散层合称为胶体微粒或胶胞。
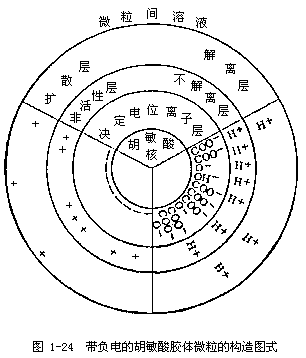
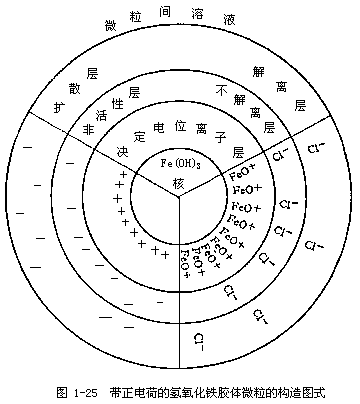
由于胶粒的电荷性质决定于直接附着在微粒核上的离子,即决定于内层的电荷。若阴离子被固定在微粒核上,则胶粒就带负电荷,如图1-24所示。若阳离子被固定在微粒核上,则胶粒就带正电荷,如图1-25所示。
(二)土壤胶体的性质
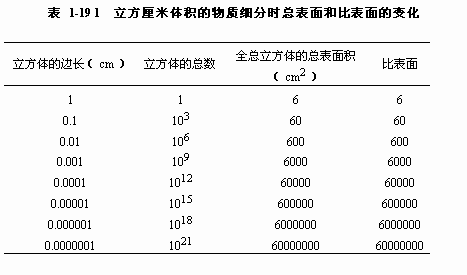
1.巨大的比表面和表面能 比表面是指单位重量固体颗粒的表面积。物体分割得愈细小,单体数愈多,总面积愈大,比表面也愈大。一个边长为1厘米的立方体,总表面积为6平方厘米,如把它分割成边长为1微米的小立方体,虽然其总重量和总体积不变,但总表面积则达6平方米,增加了1万倍。把它不断分割下去,表面积就更大了(表1-19)。当固体物质分割到粒径小于100毫微米时,就因总的表面积增大而获得胶体性质。
土壤胶体根据其表面的位置,可分为内表面和外表面。除粘土矿物、氧化物与腐殖质胶体存在外表面外,一般膨胀型粘土矿物的晶层间和腐殖质分子聚积体内部存在着内表面。内表面的分子在各方面都和它相似的分子相接触,受它们的相等吸引力所均衡,没有多余的自由能,外表面的分子有些部分与外界的液体或气体介质相接触,因表面分子受到内部和外部两种不同的吸引力,从而产生了多余的自由能。这种由物体表面的存在而产生的能量,称为表面能。物体的比表面愈大,表面能也愈大,吸收性能也愈强。
2.土壤胶体的带电性
1)土壤胶体电荷的起因:土壤胶体一般都带有电荷,土壤胶体电荷产生的原因是多方面的,其中主要原因有三方面:
(1)同晶置换作用 土壤粘土矿物中,组成铝硅酸盐矿物晶层的硅四面体和铝八面体中,并不完全是硅和铝离子,可因同晶质置换作用而使其带有电荷,如硅氧四面体中的四价硅被三价铝置换,八面体中的三价铝被二价镁或铁置换,都产生过剩的负电荷。相反,当晶形矿物或层状粘土矿物晶格中的低价离子为高价离子置换时,产生的是正电荷,如四价钛离子对三价铁离子的置换等。由于同晶置换作用发生在晶格的内部,其置换电荷的数量决定于晶格中同晶置换的多少,而与溶液pH值变化等无关,故称为永久电荷或恒电荷。一般同晶置换的电荷多带负电荷,故称为永久负电荷。由这种方式形成的负电荷量,以蒙脱石较多,水云母次之,高岭石最少。
(2)晶格破碎边缘的断键 在矿物风化破碎的过程中,晶体晶格边缘的离子有一部分电荷未得到中和,而产生剩余价键,使晶层带电。粘土矿物因破裂断键而产生的电荷,大多为负电荷,例如,晶格在硅层或铝层截面上断裂,Si—O—Si、Al—O—Al在断裂后,断面上留下Si—O-、Al—O-,从而带负电,因破裂断键产生的负电荷,高岭石类最多,水云母次之,蒙脱石较少。
(3)胶体向介质解离或吸附离子而带电 例如,晶格表面OH-基,在介质pH变化时,晶格表面的OH-基会发生解离,如高岭石结构中OH-基在pH>5时解离出H+,使胶体带负电荷,而介质pH<5时则解离出OH-,使胶体带正电荷;粘土矿物表层的Fe,Al等离子从溶液中吸收各
![]()
粘土矿物表面的氧离子也可吸收H+而增加正电荷。这两种方式产生的电荷随介质pH值的变化而变化,叫做可变电荷或添加电荷。
由胶体表面分子的解离和从介质中吸附离子而使胶体带电,在很多情况下是统一的,例如一种分散在土壤水中的胶体,如其化学成分中也含有水,如含水氧化铁、含水氧化铝,则其电性的产生可以解释为,H2O分子的解离而获得,也可解释为,从周围介质中吸收H+或OH-而获得。例如Al(OH)3 在酸性环境中带正电,可以解释为由于Al(OH)3 解离出OH-离子的缘故:
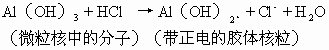
也可解释为,从介质中吸收了H+离子而带电:
Al(OH)3+H+→Al(OH)3H+,即 Al(OH)2(H2O)+
氢氧化铝在碱性环境中带负电,也可用上述两种原因去解释:
解离H+离子: Al(OH)3+NaOH→Al(OH)2O-+Na++H2O
吸收OH-离子: Al(OH)3+OH-→Al(OH)2O(H2O)-
象Al(OH)3在酸性条件下解离OH-或吸附H+,本身带正电荷者,是酸胶基;在碱性条件下解离H+或吸附OH-,本身带负电荷者,称为碱胶基。由于它的电性随酸碱条件而变化,既可带正电又可带负电,因而把这种胶体叫两性胶体。
土壤中带负电的胶体,例如,含水氧化硅(SiO2·nH2O),因它外层分子发生解离,使胶体带负电(SiO32-),被解离出的H+离子散布在周围溶液中,这样使得氧化硅胶体本身象普通酸类的酸根一样,称为酸胶基,但不具两性。
土壤从酸变碱或从碱变酸,两性胶体均要发生电荷符号的改变,即由正变负,或由负变正,在这种变化过程中,所经历的一点的电性既不是正,也不是负的瞬间,即电性正、负相等时的pH值为等电点。土壤中Al(OH)3胶体在等电点时,pH值在5—6之间。土壤胶体在等电点时,原来呈溶胶状态的胶体,逐渐相互结合成团聚体而沉淀。这种现象称为胶体的凝聚作用。凝聚作用对土壤结构的形成有积极的作用。
2)土壤胶体电性的强度:根据胶体的双电层构造,胶体带电主要决定于决定电位离子层。决定电位离子层与溶液介质间的电位差,叫热力电位,通常用ε表示,在一定胶体系统内,它的大小是不变的。在非活性补偿离子层与溶液介质间的电位差,叫电动电位,用ζ符号表示,它的大小随扩散层的厚度而变化,当扩散层厚度增大时,电动电位势增强;扩散层厚度减小时,电动电位势降低。胶体所显示的电性强弱,就是决定于这个电动电位(图1-26)。由于胶体带有电荷,可以吸收保持带有相反电荷的离子。处于扩散层的离子,由于离开决定电位离子层较远所受引力较小,有较强的热运动,易于扩散到微粒间溶液中去。而在微粒间溶液内和它带有相同电荷符号的离子因受决定电位离子层电荷的吸引,使离子能进入双电层外层成为补偿离子而被吸引,从而引起了离子代换吸收,称为物理化学吸收现象。
3.土壤胶体的分散和凝聚 土壤胶体可以呈溶胶和凝胶两种形态存在,而且两者可以相互转化。由溶胶转为凝胶,称为凝聚作用;相反由凝胶分散为溶胶,称为消散作用。
土壤胶体分散的发生,是因为胶粒间带同电荷,互相排斥,不易凝聚。电动电位愈大,相斥力愈大,溶胶状态也愈稳定。同时由于胶体微粒表面有水膜层,妨碍彼此接近,因而不能降低胶粒的负电性,或电动电位,从而使胶粒彼此排斥而呈分散状态。此外,由于亲液胶体(有机胶体)包围在疏液胶体周围,促使胶体分散。溶液碱性增强,OH-浓度增多,亦能促使胶体分散。一价阳离子代换了二、三价阳离子,使凝胶遇水分而分散。过剩的电解质,在淋洗作用下被淋溶时,也能促使胶体分散。
要使土壤溶液发生凝聚而变成凝胶,主要是通过降低胶体的电动电位来进行,降低电动电位的方法有:给胶体溶液增加电解质或加入带相反电荷的胶体或离子。降低胶体水化程度,如降低水膜厚度、增加阳离子浓度。改变溶胶的pH值,如降低pH值。干燥或冻结、胶体陈化等,都能使溶胶凝聚成凝胶。
电解质对溶胶的凝聚作用最重要,因为加入电解质后,可使电解质中的阳离子中和土壤胶体的负电荷,减小扩散层的厚度,降低电动电位,促使胶粒彼此接触而凝聚成凝胶。电解质凝聚能力的大小,可用电解质使溶胶开始凝聚时的浓度(叫凝固点)来说明。
电解质中离子凝聚能力:三价>二价>一价,即离子价数高者凝聚能力强,价数低者凝聚能力弱。土壤中常见电解质阳离子凝聚力大小的顺序是:
![]()
胶体的凝聚作用有的是可逆的,有的是不可逆的。一价阳离子所引起的凝聚作用是可逆的,二价和三价阳离子引起的凝聚作用是不可逆的。因为二、三价阳离子具有两个以上的价键,可同时粘结在两个胶粒上,凝聚力强,使胶粒联系得极紧密,使水分子不易渗入粒间孔隙而分散胶粒。而一价阳离子,如Na+,不能同时连接两个胶粒,而且水化能力强,遇水即可充满水膜而使胶粒分散开来。由上述可见,土壤胶体凝聚和分散作用对土壤中物质的聚集和淋移、土壤结构的形成和破坏以及土壤肥力的变化是密切相关的。
(三)土壤的离子交换
土壤胶体表面吸收的离子与溶液介质中其电荷符号相同的离子相交换,称为土壤的离子吸收和土壤的离子交换作用。根据土壤胶体吸收与交换的离子不同,可分为阳离子的吸收和交换作用与阴离子的吸收和交换作用。简称土壤的离子交换(ion-exchange of soil),其中主要是土壤阳离子的交换。
1.土壤中阳离子交换作用
1)阳离子交换作用:土壤中带负电荷的胶粒吸附的阳离子与土壤溶液中的阳离子进行交换,称为阳离子交换(吸收)作用(cation exchange)。阳离子交换作用具有以下几个特点:
(1)可逆反应并能迅速达到平衡
![]()
当反应达到平衡后,如果溶液中的离子组成或浓度改变,则胶体上的交换性离子就要和溶液中的离子产生逆向交换或新的交换。如上述反应平衡式,若再加入CaCl2,则交换反应发生逆转,Ca2+重新把胶粒上吸附的一部分K+交换出来。
(2)阳离子交换按当量关系进行 即离子间的相互交换以离子价为依据作等价交换。例如,二价钙离子去交换一价钠离子时,一个Ca2+可交换两个Na+。也就是说,40克的钙离子(1摩尔的钙)可以交换46克的钠离子(2摩尔的钠)。因为土壤胶体上交换性离子数量有限,一般用厘摩尔(+)每千克土或cmol(+)kg-1表示。
(3)阳离子代换力 一种阳离子将其他阳离子从胶粒上代换下来的能力,称为阳离子代换力。各种阳离子代换力的大小顺序,与它们对溶胶凝固能力的大小顺序相一致,即:
![]()
阳离子代换能力的大小,受下列几种因子支配:
① 阳离子代换能力随离子价数增加而增大,因为价数高的阳离子电荷量大、电性强,所以代换能力也大,例如:
Na+<Ca2+<Al3+<Ti4+
② 等价离子代换能力的大小,随原子序数的增加而增大,例如:
![]()
Mg2+<Ca2+<Sr2+<Ba2+<Ra2+
在等价离子中,原子序数愈小的离子的半径愈小,离子表面电荷密度愈大,因而离子的水化度大,水膜厚,即水化后的有效半径大,则离子交换能力愈小。因此,等价离子的交换能力随水化度的增加而减小。
③ 离子运动速度愈大,交换力愈强。如H+由于半径小,水化很弱,运动速度大,因而代换力强,它不仅大于一价的阳离子,而且大于二价的阳离子Ca2+和Mg2+。土壤中常见离子代换能力大小的顺序是:
![]()
④ 阳离子代换能力受质量作用定律的支配,即离子浓度愈大,交换能力愈强。例如,施硫酸铵离子于土壤中,其中NH4+可以代换土壤胶体中的Ca2+。
2)阳离子交换量:每千克干土中所含全部阳离子总量,称阳离子交换量(cation exchange capacity),或称交换性阳离子总量,也可简称交换量,以厘摩尔(+)每千克土或以c mol(+)kg-1表示。不同土壤的交换量不同,受下列因素的影响。
(1)胶体的种类 不同胶体类型,其交换量也不同,如表1-20所示。粘土矿物的交换量一般是,蒙脱石>水化云母>高岭土;含水氧化铁、铝的交换量极微;有机胶体的交换量可高达150—700厘摩尔(+)每千克土。因此,腐殖质含量高的土壤交换量远高于粘土矿物。

(2)溶液的pH值 这是影响胶体负电荷的主要因素。一般随pH值的增加,土壤负电荷量随之增大,交换量增大,例如,当溶液pH为2.5—6.0时,高岭石的负电荷数为4厘摩尔(+)每千克土,蒙脱石为95厘摩尔(+)每千克土;pH为7时则分别增至10厘摩尔(+)每千克土和100厘摩尔(+)每千克土。
此外,阳离子交换量与土壤质地的粗细亦有关,质地愈细,交换量愈高。
3)土壤盐基饱和度:土壤交换性阳离子,包括H+和盐基离子,如Ca2+、Mg2+、Na+、K+、NH4+等。交换性盐基离子总量占交换性阳离子总量的百分比,称为盐基饱和度(basesaturation),其按下列公式计算:
![]()
![]()
在土壤吸收复合体中,交换性阳离子均为盐基者,称为盐基饱和。若岔有H+和Al3+者,则为盐基不饱和,但在实际划分饱和、不饱和土壤时,一般以盐基饱和度70%或50%为界线。不同地区的土壤,其盐基饱和度是不同的。一般来说,干旱、半干旱及半湿润地区的土壤,为盐基饱和的土壤;温带、亚热带、热带湿润地区的土壤,为盐基不饱和的土壤。
2.土壤中阴离子交换作用 土壤中带正电荷的胶粒所吸附的阴离子与土壤溶液中阴离子的交换作用,称阴离子交换作用(anion exchange)。土壤胶体带正电荷的原因是多方面的,例如,土壤中的两性胶体,如含水氧化铁、含水氧化铝,在酸性条件下带正电荷;某些带负电荷的胶体的某些部位上也可能带有正电荷,如硅酸盐粘土矿物晶格碎片外部边缘上的Si、Al、Fe、Mg等离子的正电荷;吸收性复合体中SiO2/R2O3比值近于1时,也带正电荷;有机胶体的基性组成部分,在酸性溶液中能产生正电荷,如NH3+H+→NH3。因而这些胶体是土壤阴离子交换作用的物质基础。
阴离子交换吸收作用有些也是可逆反应的,并能很快达到平衡,而平衡的转移也受质量作用定律的支配。但是,土壤中阴离子的交换吸收作用往往和化学的固定作用同时发生,很难区分两者的差异。另外,阴离子交换吸收不象阳离子交换吸收那样具有明确的当量关系。由于被吸收的阴离子往往转而固定在土壤中,所以常常把阴离子交换吸收和其后的化学固定作用,混称为阴离子的吸收作用。
土壤中常见阴离子吸收性能有:
![]()
![]()
子进行化学反应,产生难溶性化合物而被固定在土壤中,如磷酸离子与钙离子形成易溶性Ca(H2PO4)2·H2O,较难溶的CaHPO4·2H2O
![]()
FePO4,即所谓化学固定作用。土壤吸收力的大小视形成的物质的溶解度而定,溶解度小,则吸收力大。
![]()
这些阴离子和溶液中的阳离子不能形成不溶性盐类。其次,因为它们只有在极酸性的反应下才能被吸收。
![]()
离子。
土壤中阴离子吸收能力的顺序如下:
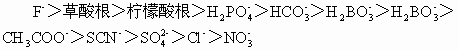
由于土壤中阴离子吸附常伴随化学反应,使得对阴离子吸收交换机制的认识更为困难。目前的研究是把阴离子的吸附和交换机理分为两类:一是专性吸附;二是非专性吸附。
非专性吸附(unspecialized adsorption),带正电荷的胶体所吸附的阴离子与土壤溶液中阴离子的相互交换,称为非专性吸附,亦称为阴离子的正吸附。这种吸附发生于胶体扩散层,与氧化物的配位壳之间,被水分子层隔离,故键合很弱,易于解吸或被水洗出,通常把土壤胶体吸附
![]()
一般法则。
专性吸附(specitic adsorption),与非专性吸附相反,胶体表面不一定带有正电荷,或正电荷已为阴离子所中和,甚至带有负电荷,被吸附的阴离子不是在扩散层,而是进入胶体双电层的内层,并交换金属离子氧化物表面的配位阴离子。因此,专性吸附又称为配位体交换。专性吸附的阴离子不能为非专性吸附的阴离子所交换,但非专性吸附的阴离子可以从扩散层进入内层,变成专性吸附,即通常说的固定。
土壤中进行专性吸附的铁、铝氧化物的凝胶,如针铁矿、水铝石、三水铝石、水铝英石和其他无定形的水化氧化物等,它们中的金属离子都为OH-所配位,其中一部分能直接和专性吸附的阴离子进行交换,含水氧化铁、铝经脱水后,则专性吸附力大大降低。
专性吸附较好地解释了,为什么水化氧化物及水铝英石含量多的土壤,对阴离子具有强烈的吸附现象,改变了过去那种纯化学固定的概念,因此,是土壤吸附机理研究的重要进展。
阴离子吸附能力的大小,一般地说,它与胶体种类、电解质溶液浓度、pH值、离子大小,以及吸收后形成的复合体的溶解度有关。2∶1
![]()
石,以及含水氧化铁、含水氧化铝等易带正电的胶体,对阴离子的吸附
![]()
和本身价数的影响,阴离子吸附力随阴离子价数递减而递减。阴离子吸附量随电解质溶液中离子浓度的增加而增大,但随pH值升高、负电荷增大而减少,并在某一pH值时出现负吸附,由正吸附转变为负吸附的阴离子等电点,随溶液浓度增高而升高。此外,阴离子半径愈接近OH-的半径(0.132-0.140nm)者,其交换吸收力愈大,如F-的半径为0.133nm,其交换力最大。阴离子形成的复合的溶解度愈小,其交换力也愈大。
非专性吸附的交换量是随土壤中胶体正电荷数量的增加而增加,随pH值的升高而降低的。专性吸附的交换量与土壤中含水氧化物的数量呈正相关,富含水化氧化物的土壤中非专性吸附最为明显。
3.土壤的其他吸收作用 根据苏联土壤学家К.К.盖德罗伊茨(Гедройц)对土壤吸收作用的分类,土壤除具有上述物理化学吸收作用外,还有机械、物理、化学和生物吸收作用。
1)土壤机械吸收作用:土壤是一个多孔体,里面具有大小不同的孔隙,好象过滤器一样,它能把大于孔隙的物质留下来,这种作用称为土壤的机械吸收作用。某些土壤的淀积层(或心土层)的发育,是与土壤的机械作用密切相关的。
2)土壤物理吸收作用:土壤的物理吸收作用又称为非极性吸收,或分子吸收作用。主要是指,由于胶体借表面能,从溶液和空气吸附和保持一些分子物质(如CO2、H2O、H2、NH3等)的作用。一些物质,如有机酸、醇、有机碱等,能够使溶液的表面张力减低,或降低胶体的表面能,而自己则被吸附保持于胶体表面附近,这种吸附称为正吸附;另一类物质,如无机酸、无机盐类等,可使溶液表面张力增大,增加表面能,自己则不被胶体表面所吸附,而是远离胶体表面溶液的浓度增加,这种吸收称为负吸附。
物理吸收可吸收一部分养分免于淋失,同时使土壤溶液的浓度不均,有利于植物根系的选择性吸收。
3)土壤化学吸收:土壤溶液中可溶性物质生成难溶性物质的沉淀过程,称为化学吸收作用。如施磷肥,常发生下列反应:
Fe(OH)3+H3PO4→FePO4↓+3H2O
3Ca(OH)2+2H2PO4→Ca3(PO4)3↓+6H2O
化学吸收作用的实质是养分的固定作用。它虽能使养分固定在土壤中免于淋失,但对植物有效性养分的供应不利。
4)生物吸收作用:生物吸收作用实际是指生物有机体对土壤养分的选择性吸收,并以有机质形式在土壤中积累的过程。由这种作用的效应是,使土壤中积累的灰分元素和含氮的有机质,再通过微生物的分解,重新释放出来,以供植物利用。它对土壤肥力是很重要的。
本文标题:土壤性质(3)
手机页面:http://m.dljs.net/dlsk/turangxue/10909.html
本文地址:http://www.dljs.net/dlsk/turangxue/10909.html

